穩(wěn)轉(zhuǎn)株構(gòu)建
目錄價
¥ 0.00
 一鍵復制產(chǎn)品信息
一鍵復制產(chǎn)品信息
產(chǎn)品推薦
聯(lián)系方式
- 電話:400-1016-218
- 郵箱:355185756@qq.com
- 地址:安徽省合肥市高新區(qū)黃山路602號合肥國家大學科技園A401室
產(chǎn)品詳情
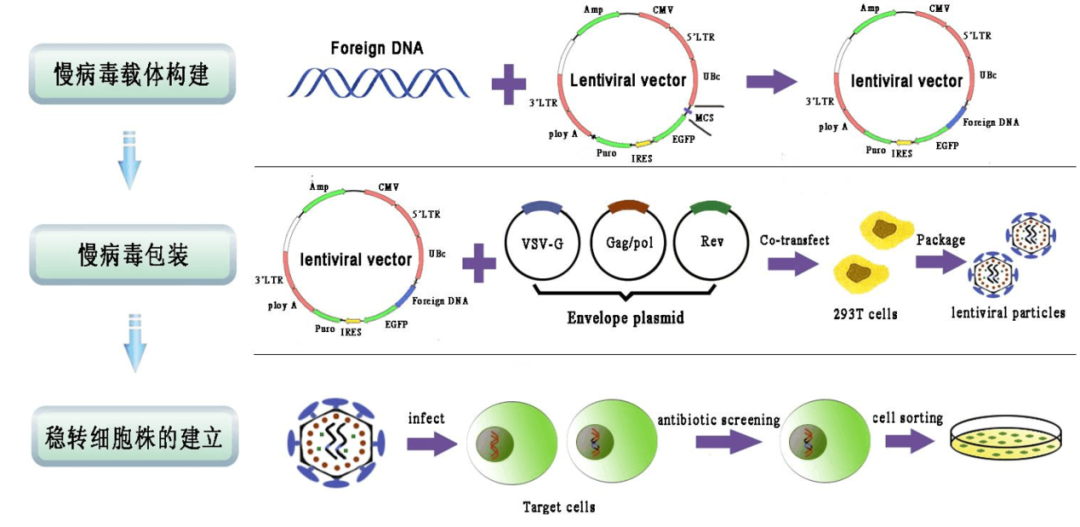
1、穩(wěn)轉(zhuǎn)株構(gòu)建流程
穩(wěn)轉(zhuǎn)株即穩(wěn)定表達細胞株,指的是基于某一細胞系構(gòu)建的持續(xù)過表達或干擾某特定基因的細胞系。用轉(zhuǎn)染質(zhì)粒或病毒侵染的方法將構(gòu)建好的含靶基因的載體導入細胞,根據(jù)不同的基因載體中所含的抗性標志選用相應的藥物進行篩選混合陽性克隆。針對瞬時轉(zhuǎn)染,外源基因在短時間轉(zhuǎn)錄翻譯得到的蛋白量很少,能夠滿足小量蛋白的制備,大量生產(chǎn)成本很高。慢病毒感染-藥物篩選法是目前廣泛運用的穩(wěn)轉(zhuǎn)株構(gòu)建方法,具有高效整合,目標細胞廣泛等特點。最常用的真核表達載體抗性篩選標志物有新霉素(neomycin),潮霉素(hygromycin)和嘌呤霉素(puromycin)。常用G418來代替新霉素進行選擇性篩選,篩選得到可穩(wěn)定表達目的蛋白,或者穩(wěn)定表達沉默特定基因的細胞株。
2、準備及預實驗
【1】確定目標細胞系的相關(guān)信息
(1)包括細胞的培養(yǎng)條件,細胞的增值速度,支原體污染情況。
【2】預實驗確定MOI值
(2)查閱文獻確定慢病毒在目標細胞系中的MOI值
(3)參考查閱得到的數(shù)據(jù),設計梯度實驗,摸索最適MOI
【3】預實驗確定篩選藥物用量
(1)查閱puro/G418/潮霉素等在目標細胞系中穩(wěn)轉(zhuǎn)株篩選的致死用量信息
(2)參考查閱得到的數(shù)據(jù),確定3個藥物濃度梯度(如沒有相關(guān)信息,則需將藥物濃度梯度范圍增大數(shù)量增多至6個)
(3)第一天將細胞鋪于6孔板中,使細胞到第二天的密度約90%
(4)第二天按設置的藥物濃度加入藥物
(5)第四天換液,并重新加入藥物
(6)第七天觀察,找到細胞致死率100%時藥物濃度最低的孔,該孔使用的藥物濃度為藥物篩選濃度
3、脂質(zhì)體轉(zhuǎn)染篩選穩(wěn)轉(zhuǎn)株
【1】將復蘇后常規(guī)的細胞按照1-3×10^5接種到6孔板中,加入2-4ml的完全培養(yǎng)基,混合放置在二氧化碳培養(yǎng)箱中37℃過夜。
【2】第二天進行轉(zhuǎn)染,在無菌條件下配置如下溶液:a 用250ml的無血清培養(yǎng)基稀釋4ug的待轉(zhuǎn)染的質(zhì)粒。b 用250ul的無血清培養(yǎng)基稀釋6ul的lipo轉(zhuǎn)染試劑。各自孵育5min(血清的存在會影響轉(zhuǎn)染效率,因此要使用無血清培養(yǎng)基轉(zhuǎn)染)
【3】將ab溶液混合,室溫下孵育20min。
【4】在進行(2)(3)之前或過程中,細胞培養(yǎng)至80%單層左右,用PBS洗滌細胞一至兩次,每孔加入1.5ml的無血培養(yǎng)基,并將混合后的ab溶液逐滴加入到每孔中,按十字方向輕搖混勻,二氧化碳培養(yǎng)箱中培養(yǎng)4-6h。
【5】將轉(zhuǎn)染液倒出,換為完全培養(yǎng)基繼續(xù)培養(yǎng)。
【6】48h后加入選擇性抗生素進行穩(wěn)轉(zhuǎn)株篩選,預實驗確定抗生素的殺傷濃度。
4、病毒感染篩選穩(wěn)轉(zhuǎn)株
【1】細胞鋪板:將細胞接種于6孔板中,使細胞在第二天的密度達到約70%左右
【2】病毒感染:根據(jù)預實驗確定的MOI值,計算需要加入的慢病毒體積
【3】換液:根據(jù)實際情況進行換液,對于一些耐受弱的細胞,就要及時進行換液;一些耐受強的細胞,則可以感染48-72h再進行換液
【4】觀察感染效率:感染后72h,觀察感染效率,效率最低不應低于40%
【5】 篩選
(1)嘌呤霉素篩選:嘌呤霉素最佳的作用時間是3-10天之間,嘌呤霉素常用濃度范圍在1-10μg/ml。
通過預實驗確定了最佳篩選濃度后,就可以做病毒感染了。
a.感染: 感染培養(yǎng)72h(感染時間根據(jù)細胞的具體情況及感染效率而定)后在6孔板中加入之前預實驗確定的藥物濃度
b.加puro:在6孔板中加入之前預實驗確定的puro藥物濃度
c.換液:根據(jù)培養(yǎng)基的顏色和細胞生長情況,每3~5天更換一次篩選培養(yǎng)基。當有大量細胞死亡時,可以把puro濃度減半維持篩選
d.觀察:每天觀察細胞的狀態(tài),生長情況以及基因表達的水平及所占比例,直至顯微鏡下觀察熒光細胞比例為90%以上。
(2)G418篩選:由于每種細胞對G418的敏感性不同,一般變動在100ug/ml~1000ug/ml范圍。
通過預實驗確定了最佳篩選濃度后,就可以做病毒感染了。
a.感染:感染培養(yǎng)48小時或者更長,到細胞增長接近匯合時按1:4密度傳代,繼續(xù)培養(yǎng),待細胞密度增至50%~70%匯合時;
b.加G418:去掉培養(yǎng)液,PBS洗一次,加入按最佳篩選濃度配制好的G418篩選培養(yǎng)基。
c.換液:根據(jù)培養(yǎng)基的顏色和細胞生長情況,每3~5天更換一次篩選培養(yǎng)基。當有大量細胞死亡時,可以把G418濃度減半維持篩選。
d.觀察:每天觀察細胞的生長情況及熒光的所占比例,直至顯微鏡下觀察熒光細胞比例為90%以上。
(3)潮霉素篩選:潮霉素用來篩選穩(wěn)轉(zhuǎn)株的工作濃度需要根據(jù)細胞類型,培養(yǎng)基,生長條件和細胞代謝率而變化。推薦使用濃
度為50-1000μg/ml。一般而言,哺乳動物細胞50-500μg/ml,細菌/植物細胞20-200μg/ml,真菌300-1000μg/ml。對于第一次使用的實驗體系建議通過建立殺滅曲線即劑量反應性曲線,來確定最佳篩選濃度。
并非所有的病毒載體都適合用來進行穩(wěn)定株篩選,首先需要挑選整合效率高,整合位點穩(wěn)定的病毒載體。至今為止,逆轉(zhuǎn)錄病毒載體是最有效的可以介導基因整合的病毒載體。其次,依據(jù)具體實驗要求,挑選不同整合位點傾向性的逆轉(zhuǎn)錄病毒載體。
傾向于整合于轉(zhuǎn)錄起始位點附近的,容易造成下游基因的激活; 而整合于轉(zhuǎn)錄活躍基因內(nèi)的,容易導致整合區(qū)基因的插入失活。
常見問題
答:公司提供兩種運輸方式供老師選擇,1、復蘇的活細胞:采用常溫發(fā)貨的方式,收到即可觀察密度并判斷是否進行傳代操作。優(yōu)勢是省去復蘇的步驟,細胞成活率較高。2、凍存的細胞:采用干冰運輸,一般情況下發(fā)貨是2支凍存管,收到后放-80過夜,第二天轉(zhuǎn)入液氮長期存儲,擇機復蘇。優(yōu)勢是發(fā)貨快,一般一兩天即可收到,缺點是需要自己復蘇。
答:我公司提供的細胞大部分都參考資源庫的培養(yǎng)信息,如ATCC、DSMZ、中科院等等官方平臺。也有少部分細胞為客戶提供了替代培養(yǎng)方案,根據(jù)客戶的意愿進行選擇!
答:不可以重復使用,一般從我公司發(fā)出的細胞都需要達到一定的密度后發(fā)出,充液的培養(yǎng)基血清比例會比正常培養(yǎng)時所用到的培養(yǎng)液低很多,通常在3-5%,以維持細胞存活,控制生長速度,不可以用來做細胞培養(yǎng)使用。
答:細胞在鏡下發(fā)現(xiàn)圓形的白色的點點,一般情況下是為貼壁的細胞或脫落的細胞死亡后的產(chǎn)物,懸浮細胞也會有這種現(xiàn)象,出現(xiàn)圓形的光圈一樣的圓點。通常,白色的圓點是分散分布的,聚團類的懸浮細胞可能會聚團出現(xiàn)白色的亮斑,技術(shù)老師可以繼續(xù)培養(yǎng)并觀察。
答:一般情況下,我公司建議客戶收到細胞后傳1-2代后即可安排凍存留種,可先凍存1-2支凍存管,凍存的細胞數(shù)量多一些,便于后期復蘇。購買原代細胞的客戶,要充分考慮該細胞的傳代次數(shù)限制,人源原代細胞大概可以傳7代左右,鼠源的可以傳3代左右,對于一些能傳代次數(shù)很少的原代細胞,不建議凍存,收到后調(diào)整狀態(tài)后即可安排實驗。














 皖公網(wǎng)安備 34010402703761號
皖公網(wǎng)安備 34010402703761號





 夏經(jīng)理:341412994
夏經(jīng)理:341412994














